Jugando con moléculas
Publicado el 4 de Noviembre de 2025 | Física y Química

A mediados del siglo XIX, el químico August Wilhelm von Hofmann quiso mostrar de manera tangible cómo se ordenan los átomos en el espacio cuando se forman moléculas. Para ello, presentó un conjunto de bolas de madera unidas con varillas, cada color representando un elemento, que permitía que las estructuras moleculares se pudieran tocar y rotar.
Fue esta representación la que permitió que la química empezara a pensarse en tres dimensiones. No todas las moléculas tenían por qué ser planas y de hecho, la representación tetraédrica del carbono permitiría explicar la quiralidad de los compuestos orgánicos.
Durante el siglo XX, los modelos con los que se representaban estas moléculas eran herramientas de laboratorio construidas con madera y acero, más tarde se convirtieron en material escolar de plástico.
Hoy, los programas informáticos permiten girar, deformar y comparar moléculas fácilmente, pero para entender cómo se organiza la materia nada sustituye la experiencia de construir con las manos.
Para muchas personas, el aprendizaje de la química empieza con una sensación de desconcierto. Las fórmulas y reacciones parecen jeroglíficos, al principio parecen tan abstractas que cuesta asimilar que reflejan la realidad.
Cuando el alumnado comienza a estudiar formulación inorgánica, la capacidad de abstracción es clave. En los compuestos inorgánicos, la dificultad aumenta: los átomos y enlaces se multiplican de modo que las moléculas resultan intimidantes.
Aquí es donde entran los modelos físicos de representación molecular a través de los cuales el alumnado puede observar, construir y deducir. Así, de la observación directa de una molécula orgánica se pueden inferir las valencias de los elementos más comunes, ya que el carbono siempre aparece con cuatro enlaces, el nitrógeno con tres, el oxígeno con dos y el hidrógeno con uno. La abstracción se convierte en observación. La química, en algo tangible.
Aplicación en el aula
En esta ocasión te invitamos a utilizar un kit de modelos moleculares tridimensionales como herramienta para que el alumnado explore la estructura de diferentes moléculas y comprenda cómo se enlazan los átomos.
Te recomendamos que comiences con moléculas inorgánicas sencillas que te permitan ir presentando diferentes características. Lo ideal es que organices a tus estudiantes en grupos para que monten las moléculas con tus indicaciones:
Hidrógeno (H₂). Dos átomos de hidrógeno unidos por un enlace simple.
Cloruro de Sodio (NaCl). Un átomo de sodio y uno de cloro unidos por un enlace simple.
Oxígeno (O₂). Dos átomos de oxígeno unidos por un doble enlace.
Nitrógeno (N₂). Dos átomos de nitrógeno unidos por un triple enlace.
Agua (H₂O). Dos átomos de hidrógeno y uno de oxígeno unidos por 2 enlaces simples.
Hipoclorito de sodio (NaClO). Un átomos de sodio, uno de oxígeno y otro de sodio unidos por enlaces simples
Dióxido de carbono (CO₂). Un átomo de carbono y dos de oxígeno unidos por dos enlaces dobles.
Metano (CH₄). Una estructura tetraédrica compuesta por un átomo de carbono y 4 de hidrógeno.
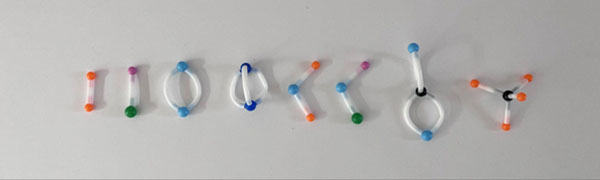
A continuación, te proponemos un par de ejemplos concretos de moleculas más complejas junto con curiosidades que te ayudarán a llamar la atención del estudiantado.
En primer lugar, te proponemos construir una molécula inspirada en la hemoglobina, la proteína responsable del transporte de oxígeno en la sangre. Para ello, puede utilizarse una esfera metálica o gris que represente el hierro, rodeada por un anillo formado por átomos de carbono, nitrógeno y oxígeno. En el centro de ese anillo se coloca el átomo de hierro, al que en nuestro modelo se unen dos pequeñas esferas azul claro que simbolizan las moléculas de oxígeno. El conjunto permite visualizar cómo el oxígeno se fija temporalmente al hierro mediante un enlace reversible que se forma al inhalar y se rompe al exhalar.
Otro ejemplo muy interesante es el del funcionamiento de la lejía doméstica. Esta sustancia actúa sobre los pigmentos haciendo que en pocos segundos el color comience a desvanecerse hasta desaparecer, como si la sustancia hubiera sido eliminada.
Sin embargo, lo que ocurre es una modificación en la estructura molecular del pigmento. Si se representa el proceso con un modelo molecular, el alumnado puede construir la molécula de dibromoantantrona, un pigmento orgánico de color rojo anaranjado con un sistema de anillos aromáticos fusionados con dobles enlaces conjugados, responsables de que la molécula absorba ciertas longitudes de onda de la luz y refleje otras, generando el color que percibimos.
Al añadir el oxígeno de la lejía al modelo, se rompe parte de esa conjugación y se altera la estructura electrónica de la molécula. Aunque la sustancia siga presente, el color desaparece porque la molécula ya no absorbe luz en el rango visible de la misma manera.

Esta representación permite comprender de manera tangible que la desaparición del color es producido por un cambio profundo en la molécula, convirtiendo un fenómeno químico a nivel atómico en algo visual y manipulable.
Por Lucía García
| Anterior | Siguiente |
| Sobreexigencia y resiliencia en las aulas | ¿Qué células hay en nuestra sangre? |







